Transcription
PLS Virtual Summer School per Studenti (PVS3) – 7 settembre 2021Aequorea victoriaTavolozze biologicheLa proteina fluorescente GFP e i suoi usi nella ricercabiomedicaNicola Zambranozambrano@unina.it
Green Fluorescent ProteinLa green fluorescent protein (GFP) fu scoperta nel 1962in una medusa, l’Aequorea victoria, così chiamata perchéraccolta nella baia dell’isola Victoria in Canada.
Green Fluorescent ProteinLa medusa Aequorea victoria se ne serve come richiamo, oper spaventare eventuali predatori.La GFP, se colpita ed eccitata da una radiazione ad unaspecifica lunghezza dʼonda, è in grado di riemettere luce dicolore verde acceso.Grazie alla sua proprietà di fluorescenza, alle sue modestedimensioni è diventata negli ultimi decenni un diffuso strumentoper esperimenti e tecniche di biologia molecolare
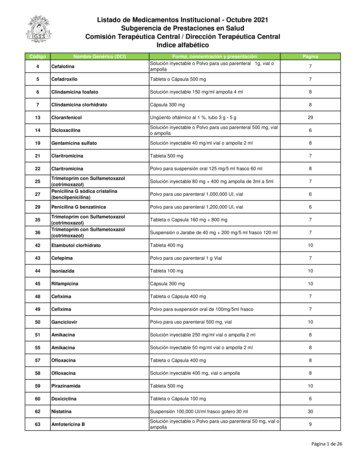
Green Fluorescent Protein?Aequorea victoriaIl Premio Nobel per la Chimica 2008 è stato assegnato a Roger Tsien,Martin Chalfie, e a Osamu Shimomura, “for the discovery anddevelopment of the green fluorescent protein, GFP”
Il Sistema Aequorin/GFPLuce AzzurraLuce Verde
Il Sistema Aequorin/GFPLuce AzzurraLuce Verde
Il Sistema Aequorin/GFPLuce AzzurraLuce Verde
Il Sistema Aequorin/GFPLuce blu
Il Sistema Aequorin/GFPLuce verde
Il Sistema Aequorin/GFP
Green Fluorescent ProteinOsamu Shimomura è stato il primo a isolare la proteina GFP e ascoprire la sua fluorescenza verde.La GFP è costituita da 238 amminoacidi e ha un PM di 27.000Dalton. È costituita da 11 foglietti beta disposti in circolo a formareuna struttura denominata barile-β (β-barrel o β-can). Inoltre sonopresenti due segmenti ad alfa elica, uno alla base del barile, l'altrolungo il suo asse centrale. Quest'ulima elica contiene il fluoroforo,ovvero la porzione in grado di assorbire la luce ed emetterefluorescenza.
Il Cromoforo Ser65-Tyr66-Gly67
Il Cromoforo Ser65-Tyr66-Gly67
Il Cromoforo Ser65-Tyr66-Gly67
https://www.youtube.com/watch?v cfg75ft7oOw
GFP COME “REPORTER” Emette fluorescenzaPuò rendere visibili cellule inorganismi trasparenti Non richiede substratiPuò permettere osservazioniin vivo Piccole dimensioniPuò essere fusa a proteinecellulari per l’analisi del trafficoe localizzazione di proteine
GFP COME “REPORTER”
GFP COME “REPORTER”
Green Fluorescent Protein Fu Douglas Prasher il primo a intuire la possibilità di usare la GFPcome reporter in organismi trasparenti e questa intuizione aprì lastrada alla straordinaria rivoluzione che ha portato la GFP a meritare ilpremio Nobel. M. Chalfie clonò il cDNA della GFP per utilizzarla come reporter (E.coli prima, C. elegans poi) per studiare il pattern di espressione di geni
Green Fluorescent ProteinNel 1994 la GFP è stataclonata.Una studentessa delgruppo di Chalfie, GhiaEuskirchen,riuscì a far esprimere ilgene della GFP, cheChalfie aveva avuto daPrasher, in E. coli,cosicché diventasse verdequando il batterio venivailluminato con luce blu.
Escherichia coli
Caenorhabditis elegans
1) Studio di promotori per analisidell’espressione genicaI geni possono essere espressi a livelli diversi inorgani/tessuti diversiCellula tessuto ApromotoreCellula tessuto Bpromotore
«istruire» una cellula o un animale conDNA della GFP ed un promotorepromotorePromotoregene AgenevirusGFPGenetrasferimentoin cellule o animali
Caenorhabditis elegans
Green Fluorescent Protein .e da allora, a scopi scientifici, industriali e commerciali, cellule, alghe, batterivermi e perfino conigli, maiali o pesci sono stati resi fluorescenti.Utilizzata come tracciante per studiare l’espressione, la funzione e il destino delleproteine.
Il Cromoforo Thr65-Tyr66-Gly67:EGFP
Il Cromoforo Thr65-Tyr66-Gly67:EGFP
Enhanced Green, Cyan andYellow Fluorescent ProteinsRoger Tsien mise a punto nuove tecniche, produsse molte proteine mutanti, cheemettono fluorescenza più rapidamente, con maggiore intensità e anche didiversi colori
di tutti i colori
https://www.youtube.com/watch?v qK9aYnkIr3w
“Brainbow”
e con l’aiuto dei coralli (Discosoma)
e con l’aiuto dei coralli (Discosoma)
e con l’aiuto dei coralli (Discosoma)
2) Uso della proteina GFP per lostudio del traffico e delleconnessioni cellulari
Attraverso semplici tecniche di Biologia Molecolaresi possono generare Proteine di Fusione
Studiare la localizzazione di proteine e il loro traffico «live»https://www.youtube.com/watch?v zyGVC2-WBcA
Un Modello per La Didattica delle Scienze Sperimentali Esistono segnali di trasporto di proteine nelnucleo? Come sono fatti questi segnali? Come si dimostra l’esistenza di questi segnali?
Struttura del nucleoMembrana nucleareMembrana esternaMembrana somiPoronucleare
Struttura del nucleo All’interno dell’involucro nuclearevi è la lamina nucleare, una rete difilamenti con funzione di supporto Il nucleo è perforato da grossestrutture note come «i complessidei pori nucleari» Costituiti da più di 50 proteinediverse chiamate nucleoporine consimmetria ottagonaleI PORI NUCLEARI NON SONO DEI SEMPLICIBUCHI!
Struttura del poro nucleare Consentono il “passaggio selettivo di molecole” Possono essere numerosi con struttura ordinataottagonale Ai pori sono associate strutture ad entrambi i lati
Alcune piccole molecole passano liberamente attraverso i poriCITOSOLNUCLEODimensioni delleproteine che entranonel nucleo perdiffusione libera 9nmSIDimensioni delleproteine che entranonel nucleo tramitetrasportatori 9nmNO
Molte molecole entrano ed escono dal nucleoCOSA ESCErRNA, tRNA, mRNA, ribosomi, proteineCOSA ENTRAProteine: polimerasi, istoni, fattori ditrascrizione,Proteine ribosomiali, etc.Nucleotidi, etc.
Esistono segnali di trasporto di proteine nelnucleo? Come sono fatti questi segnali? Come si dimostra l’esistenza di questi segnali?
Le sequenze NLS Nuclear Localization SignalsSequenze ricche di a.a. basici PKKKRKVAll’interno della proteinaFrequentemente bipartitePROTEINASEQUENZAANTIGENE T (SV40)PROTEINA 72kDa (adenovirus)VP2/3 (polioma)70kDa (drosophila)c-myc Lys-Arg-Lys-LysGlu-Gln-Lys-Arg-Arg-Arg-Arg
Le sequenze sono riconosciute darecettori specificiEsempi: Importine e TNPO11. Proteine solubili (importine) riconoscono le sequenze2. Il complesso Importina- proteina nucleare si lega alleproteine del Poro (NUP) (RIPETIZIONI FG)3. Il Poro si dilata ed il complesso lo attraversa4. L’importina si dissocia dalla proteina nucleare5. L’importina torna nel citosol
Come si dimostra l’esistenza di questisegnali? 1. RIMOZIONE DELLA SEQUENZA 2. MUTAZIONE DELLA SEQUENZA 3. TRASFERIMENTO DELLA SEQUENZA SUUN’ALTRA PROTEINA
Come si dimostra l’esistenza di questisegnali? 1. RIMOZIONE DELLA SEQUENZA 2. MUTAZIONE DELLA SEQUENZA 3. TRASFERIMENTO DELLA SEQUENZA NLS SUUN’ALTRA PROTEINAEGFP!
LA PROTEINA REPORTER PRIVA DINLS NON SI LOCALIZZA NELNUCLEOLA PROTEINA REPORTER CON NLSSI LOCALIZZA NEL NUCLEO
Clonaggio di un segnale di importo nucleare (NLS)in vettore pEGFPPreparazione e verifica dei plasmidiTrasfezione di NLS-pEGFP in cellule HEK293 Reazione di Annealing Digestione enzimatica del vettorepEGFP Purificazione del vettore medianteelettroeluizine Reazione di Ligasi Trasformazionebattericaepiastratura Miniprep Verifica della localizzazione diNLS-pEGFP mediante IF
Reazione di Annealing
Digestione del vettore pEGFP
TRASFORMAZIONE BATTERICA
Miniprep1 2 3 4 56
Trasfezione in cellule Hek2931) pEGFP2) NLS-GFP
Trasfezione234
Risultati trasfezione in cellule Hek293 dopo 48h1) pEGFP2) NLS-GFPEsperimento effettuato per verificare lalocalizzazione cellulare di unasequenza NLS legata a GFP
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
La fase dimostrativa «attiva»
PLS Virtual Summer School per Studenti (PVS3) – 7 settembre 2021Aequorea victoriaGRAZIE PER L’ATTENZIONE!Nicola Zambranozambrano@unina.it
https://www.youtube.com/watch?v x5ox71qIa-0https://www.youtube.com/watch?v jKz07IpMwJohttps://www.youtube.com/watch?v wxf4a4SX84A
Fu Douglas Prasher il primo a intuire la possibilità di usare la GFP come reporter in organismi trasparenti e questa intuizione aprì la strada alla straordinaria rivoluzione che ha portato la GFP a meritare il premio Nobel. M. Chalfie clonò il cDNA della GFP per utilizzarla come reporter (E.