Transcription
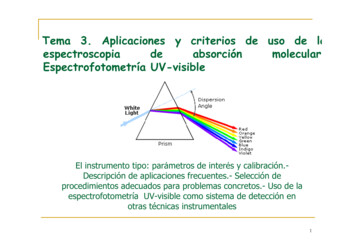
Tema 3. Aplicaciones y criterios de uso de metría UV-visibleEl instrumento tipo: parámetros de interés y calibración.Descripción de aplicaciones frecuentes.- Selección deprocedimientos adecuados para problemas concretos.- Uso de laespectrofotometría UV-visible como sistema de detección enotras técnicas instrumentales1
ESPECTROSCOPIA DE ABSORCIÓN MOLECULAR UV/VIS Fuente de radiación: lámpara de Deuterio o Hidrógeno: proporcionan espectro continuo en laregión UV (160-375 nm) lámpara de filamento de Tungsteno: radiación visible e IR cercano arco de xenón: espectro continuo entre 150 y 800 nm Selector de longitudes de onda: filtros monocromadores: de red, de prisma Recipiente muestra: cubetas cuarzo o sílice fundida para que sean transparentes a la luz(permitan en paso de radiación de la región espectral de interés) Detector de radiación:2 fotomultiplicadores o fotodiodos
mayor frecuenciaEspectro Visiblemenor frecuencialongitud de onda (nm)Violeta: 400-420 nmIndigo: 420-440 nmAzul: 440 -490 nm¿Porqué algunas sustancias se vencoloreadas y otras se ven blancas?Verde: 490-570 nmAmarillo: 570-585 nmNaranja: 585-620 nmRojo: 620-780 nm:Parte del espectro visible es absorbido yotra parte reflejado (colorcomplementario)3
Colores complementarios:Absorción a 420-430 nm: se ve amarilloAbsorción a 500-520 nm: se ve rojo.Absorción total: se ve negroReflexión total: se ve blancoSustancias coloreadas que tienen un sistema deenlaces π conjugadosOH OCH3CO2HOHHOOH Oácido carmínicoONHOHNOíndigoOOHOcrocetina4H
Figura. Instrumento medición UV/vis de un solo hazFigura. Instrumento medición UV/vis de doble haz5
Instrumento tipo- haz simple6
Espectrofotómetros de doble haz Lambda 3A y4B (Perkin-Elmer)7
8
Espectrofotómetros de diodos apilados“diode array”9
Doble haz10
11
12
Conceptos básicos Región de longitudes de onda comprendida entre 160 y780 nm (UV-vis)La espectroscopia de absorción molecular se basa en lamedida de la transmitancia T o de la absorbancia A dedisoluciones que se encuentran en cubetastransparentes con un camino óptico de b cmNormalmente, la concentración c de un analitoabsorbente está relacionada linealmente con laabsorbanciaA -log T log P0/P ε b c13
MEDIDA DE LA TRANSMITANCIADE LA ABSORBANCIAY14
MEDIDA DE LA TRANSMITANCIAABSORBANCIA Y DE LALa disolución del analito debemantenerse en algun tipo derecipiente transparente, ocubetaEn las dos interfasesaire/pared de la cubeta, asicomo en las dos interfasespared/disolucion tienen lugarreflexionesLa atenuación del haz resultante esun factor importante15
MEDIDA DE LA TRANSMITANCIADE LA ABSORBANCIA YAproximadamente el 8,5 % de un haz de luz amarilla se pierde porreflexión en su paso a través de una cubeta de vidrio rellena de aguaLa atenuación del haz puede ocurrir como, consecuencia de la dispersióncausada por moléculas grandes y, a veces, de la absorción por las paredesdel recipientePara compensar todos estos efectos, la potencia del haz transmitido por ladisolución del analito se compara, generalmente, con la potencia del haztransmitido por una cubeta idéntica que sólo contiene disolventeCon las siguientes ecuaciones se obtienen la T y A experimentales que seaproximan estrechamente a la transmitancia y absorbancia verdaderas16
LEY DE BEER Consideremos el bloque de material absorbente (sólido,líquido o gas)Un haz de radiación monocromático paralelo de potencia Pochoca contra el bloque de forma perpendicular a lasuperficie; después de pasar a través de una longitud b dematerial, que contiene n átomos, iones o moléculasabsorbentes, su potencia disminuye hasta un valor P comoresultado de la absorción.A - log T log P0 /P ε b cConsideremos ahora una sección transversal del bloque deárea S y espesor infinitesimal dx.Esta sección contiene do partículas absorbentes; asociada acada partícula, podemos imaginar una superficie en la cualtendrá lugar la captura del fotón. Si un fotón, por casualidad, alcanza una de estas áreas,inmediatamente tendrá lugar la absorción La proyección del área total de estas superficies de capturadentro de la sección se designa como dS La relación entre el area de captura y el area total, seráentonces dS/S. Estadísticamente, esta relación representa la probabilidadde captura de fotones en el interior de la sección17
Ley de Beer La potencia del haz que entra en la sección, Px, es proporcional al numero defotones por centímetro cuadrado y dPx representa la cantidad absorbida en lasección; la fracción absorbida será, entonces -dP/P, y esta relación también esigual a la probabilidad media de captura. El signo menos indica que P sufre undescenso.Recordemos, ahora, que dS es la suma de las áreas de captura de las partículasque se encuentran en la sección será proporcional al número de partículasdonde dn es el numero de partículas y a es una constante de proporcionalidad,que puede denominarse sección transversal de captura18
donde n es el numero total de partículas en elbloque19
Ley de Beer El área de la sección transversal S puede expresarse en términos devolumen del bloque V en cm3 y su longitud b en cm Como, nlV tiene unidades de concentración, es decir, numero de partículaspor centímetro, cúbico, podemos convertir nlV en moles por litro20
Ley de Beer El número de moles viene dado por:21
Aplicación de la Ley de Beer amezclas La ley de Beer también se puede aplicar a un medio quecontenga mas de un tipo de sustancias absorbentesSiempre que no haya interacción entre las distintasespecies, la absorbancia total para un sistemamulticomponente viene dado pordonde los subíndices se refieren a los componentesabsorbentes 1, 2, ., n.22
Limitaciones de la ley de Beer En algunas ocasiones estas desviaciones están relacionadascon el fundamento de la ley y representan limitacionespropias de la misma Otras veces surgen como, consecuencia de la forma en quese realizan las medidas de absorbancia o como resultado decambios químicos asociados con cambios de concentración;estas alteraciones de la ley de Beer se conocen cómo desviaciones instrumentalesdesviaciones químicas23
Limitaciones de la Ley de BeerLIMITACIONES A LA LEY DE BEERLIMITACIONES PROPIASERRORES COMETIDOS AL APLICAR LA LEYINCUMPLIMIENTO DE LAS PREMISASQUÍMICOSInteracciones por mecanismosdistintos al de absorciónINSTRUMENTALESError de lecturaSistemas enequilibrioControl de la temperaturaRadiación parásitaRadiación no monocromáticaE. De dimerizaciónUtilización y cuidado de lascubetas de absorciónE. De ácido-baseInteracciones entre las especiesabsorbentes de solutoFalta de uniformidad de la seccióntransversal de absorciónPERSONALESE. De complejaciónEfecto del disolventeImpurezas delos reactivosInterferenciasde la muestra24
Limitaciones propias de la ley de Beer La ley de Beer describe de forma correcta el comportamiento deabsorción de un medio que contiene concentraciones de analitorelativamente bajas; en este sentido, es una ley limite A concentraciones altas (generalmente 0,01 M), la distanciamedia entre las moleculas responsables de la absorción disminuyehasta el punto en que cada molécula altera la distribución de cargade las molecular vecinas Esta interacción, a su vez, puede alterar la capacidad de lasmoléculas para absorber la radiación de una determinada λ Como, la magnitud de la interacción depende de la concentración,la aparición de este fenómeno da lugar a desviaciones de lalinealidad entre la absorbancia y la concentración25
Limitaciones propias de la ley de Beer Un efecto similar se encuentra, a veces, en medios que contienenconcentraciones de absorbente bajas pero concentraciones altas deotras especies, especialmente electrolitosLa estrecha proximidad de los iones al absorbente altera la absortividadmolar de este por interacciones electrostáticas; el efecto se reducemediante diluciónAunque, normalmente, el efecto de las interacciones moleculares no essignificativo para concentraciones inferiores a 0,01 M, entre ciertos ioneso moleculas orgánicas grandes aparecen algunas excepciones. La absortividad del color del azul de metileno en disolución acuosa a 436nm aumenta un 88 % cuando la concentración del colorante aumenta de10-5 a 10-2 M; incluso por debajo de 10-6 M no se observa un cumplimientoestricto de la ley de Beer26
Otras limitaciones propias de la ley deBeer También surgen desviaciones de la ley de Beer como consecuencia de ladependencia de ε del índice de refracción del medio Si los cambios de la concentración causan alteraciones significativas en elíndice de refracción de una disolución, se observan desviaciones de la leyde Beer Para este efecto puede hacerse una corrección mediante la sustitución deε por la cantidad εn/(n2 2)2 en En general, esta corrección nunca es muy grande y rara vez essignificativa para concentraciones menores de 0,01 M.27
Desviaciones químicas de la ley deBeer Cuando un analito se disocia, se asocia o reacciona con undisolvente para dar lugar a un producto con un espectro deabsorción diferente al del analito, se producen desviaciones de laley de Beer Las disoluciones acuosas de los indicadores acido/base son unejemplo característico de este comportamiento El cambio de color asociado con un indicador típico HIn se producecomo consecuencia de los cambios en el equilibrioHIn H Incolor 1 (λ1; ε 1)color 2(λ2; ε2)28
Desviaciones químicas de la ley deBeerLa ley de Beer no se cumple, al menos que el pH sea constante, o se opere a la longitud deonda del punto isosbéstico, esto es, la λ a la cual las dos especies absorbentes en equilibriopresenten la misma ε29
Ejemplo-parte 1 Se determinaron las absortividades molares a 430 y 570 nmdel acido debil HIn (Ka 1,42 x 10-5) y de su base conjugadaIn- mediante medidas de disoluciones del indicador en mediosfuertemente ácidos y fuertemente básicosBajo estas condiciones, prácticamente todo el indicador seencontrara como HIn e In-, respectivamenteLos resultados fueron:30
Calcular los datos de absorbancia para las disoluciones no tamponadascuyas concentraciones totales de indicador están comprendidas entre 2x 10-5 y 16 x 10-5 MConcentraciones molares de las dos especies [HIn] e [In-] en una disolucióndonde la concentración total de indicador es 2,00 x 10-5 MHIn H InKa 1,42 x 10-5 [H ][In-]/[HIn]considerando que [H ] [In-]Además, la suma de las concentraciones de las dos especies del indicadordebe ser igual a la concentración analítica molar total del indicadorPor tanto, [In-] [HIn] 2,00 x 10-5Sustituyendo estas ecuaciones en la expresión para el calculo de K,obtenemos [In-]2/(2,00 x 10-5 – [In-]) 1,42 x 10-531
Reordenando los términos obtenemos la expresión cuadrática[In-]2 1,42 x 10-5 [In-] - 2,84 x 10-10 0 La solución positiva de esta ecuación es [In-] 1,12x 10-5; [HIn] 2,00x 10-5 - 1,12 x 10-5 0,88 x 10-5 Ahora estamos en condiciones de calcular la absorbancia a las doslongitudes de onda. De esta manera, sustituyendo en la ecuación deadición de las absorbanciasA εInb[In- ] εHInb[HIn]A430 2,06 x 104 x 1,00 x 1,12 x 10-5 6,30 x 102 x 1,00 x 0,88 x10-5 0,236 A 570 nm, A570 0,07332
Otras limitaciones Dimerizaciones Cuando una disolución de dicromato potásico no tamponada sediluye se produce una transformación parcial en cromato, comoconsecuencia del equilibrio dímero-monómero existente en estecompuesto Complejos Cuando se mide la absorbancia de un complejo, por ejemplo,Fe(SCN)63- para que se cumpla la ley de Beer hay que mantenerconstante la concentración de ligando libre, lo cual se consiguefrecuentemente operando en gran exceso de ligando respecto almetal33
Datos en relación a las desviacionesquímicas de la ley de Beer34
Desviaciones instrumentales originadaspor la radiación policromática El cumplimiento estricto de la ley de Beer sólo se observacuando la radiación es realmente monocromáticaEsto constituye otra manifestación del carácter límite de la leyDesafortunadamente, en la practica es difícil la aplicación deuna sola λ debido a que los dispositivos generan una banda deλs mas o menos simétrica en torno a la deseada35
Expresión de la ley de Beer enpresencia de radiación policromática Considemos un haz formado solo por dos longitudes de onda λ’ y λ’’.Asumiendo que la ley de Beer se aplica estrictamente para cada una deestas longitudes de onda, podemos escribir para la radiación λ’36
Cuando la medida de la absorbancia se realiza utilizando una radiación compuestapor ambas longitudes de onda, la potencia del haz emergente de la disoluciónviene dada por P’ P" y la del haz del disolvente por P0’ P0’’. Por tanto, la medidade la absorbancia Am Sustituyendo por P’ y P’’ se convierte en Ahora bien cuando ε’ ε’’ Y se cumple la ley de Beer37
Sin embargo, la relación entre A y la concentración deja de ser lineal cuandolas absortividades molares difieren entre si La mayor desviación de la linealidad será mayor cuando lo sea la diferenciaentre ε’ y ε’’. El mismo efecto se produciría al incluir longitudes de onda adicionales Es un hecho experimental que las desviaciones de la ley de Beer de un hazpolicromático no son apreciables, si la radiación utilizada no abarca unaregión del espectro en la cual el absorbente muestre cambios grandes en laabsorción en función de la longitud de onda38
Desviaciones de la Ley de Beer También se ha observado experimentalmente que lasmedidas de absorbancia en el máximo de los picosestrechos hace que la desviación de la ley de Beer nosea significativa si la anchura de banda efectiva delmonocromador o filtro es menor de 1/10 de la mitad dela anchura del pico de absorción en la semialtura39
40
Ruido instrumental como función de latransmitancia Una medida espectrofotométrica lleva consigo tres etapas: ajuste del 0 % de transmitanciaajuste del 100 % de transmitanciamedida del porcentaje de T cuando se sitúa la muestra en la trayectoriade la radiación El ruido asociado a cada una de estas etapas se combina para daruna incertidumbre neta en el valor final de T obtenido La relación entre el ruido encontrado en la medida de T y laincertidumbre en la medida de la concentración puede deducirseescribiendo la ley de Beer de la siguiente forma41
Para relacionar la desviación estándar de la concentración σc, con la desviación estándar de la transmitancia σT seprocede tomando la derivada parcial de esta ecuación conrespecto a T, manteniendo b y ε constantes. Es decirσ2x (δx/δp)2 σp2 (δx/δq)2 σq2 (δx/δr)2 σr2 42
Dividiendo la ecuación anteriorpor el cuadrado deSe obtiene(σc/c)2 (σT/T lnT)2σc/c σT/T lnT 0,434 σT/T logT Para un número limitado de medidas se reemplaza la desviación estándar de la población σc y σT, por ladesviación estándar de la muestra sc y sT, y se obtiene:sc/c 0,434 sT/T logT Esta ecuación relaciona la desviación estándar relativa de c (sc/c) con la desviación estándar absoluta dela medida de transmitancia (sT).Experimentalmente, sT puede evaluarse haciendo, por ejemplo, 20 replicados de la medida detransmitancia (n 20) de una disolución repitiendo las medidas exactamente de la misma formaAl examinar la Ecuación de incertidumbre en la medida de la transmitancia, vemos que la incertidumbreen la medida fotométrica de la concentración varia de forma no lineal con la magnitud de latransmitancia.La situación es algo mas complicada, porque sT depende en numerosas ocasiones también de T43
Debido a la relación logarítmica entreT y A, la precisión de la medida de laconcentración difiere según elintervalo de absorbancia que se estémidiendo:Vamos a suponer que el error relativoen la medida de T es 0,5% paratodos los valores de T entre 0 y 1Esto es un error relativo de 0,005 paraTEl error relativo en A disminuye deforma continua de mayores a menoresvalores de A (este error se calculamediante una expresión matemática).44
El error relativo en la absorbancia, es la medida de nuestraprecisión analíticaA bajas concentraciones, 90% T(A 0,045), y a concentracionesrelativamente altas, 2% T(A 1,70), el error relativo es mayordel 5%Claramente, en estas condiciones la medida es menos precisaque en otros intervalosEl intervalo en el que el error relativo para los resultados es máspequeño se encuentra en valores de absorbancia entre 0,4-0,7 ó20-60% TEn otras palabras, para alcanzar la mayor precisión en unexperimento de absorción, la concentración de la muestra o lalongitud del paso óptico a través de la muestra se deberíanajustar, si es posible, a aquella en la que la absorbancia a lasalida del instrumento esté en el intervalo de 0,4-0,7En la práctica, el error en T no es constante a lo largo de todo elintervalo, y cada instrumento tiene sus propias características%T45
Otra forma de interpretar que el error fotométrico esmenor entre valores de absorbancia de 0,4 a 0,7 esconsiderar que: si la absorbancia es baja, la potencia radiante que atraviesa lamuestra es análoga a la que atraviesa el blanco, y la incertidumbre de medida relativa a la diferencia de estos dosnúmeros sería grande al comparar intensidades parecidasPor el contrario si la absorbancia es muy alta llega pocaradiación al detector y disminuye la relación señal-ruido46
Efecto de la anchura de la rendija en las medidas deabsorbancia Para conseguir espectros complejos bien resueltos serequieren anchuras de rendija estrechas.Se ha obtenido el espectro de T de un cristal de didimiocon un ajuste de la rendija que proporciono anchuras debanda efectivas de 0,5; 9 y 20 nmLa perdida progresiva de los detalles espectrales es clara.Para estudios cualitativos, tales perdidas son, confrecuencia, de gran importanciaUn segundo efecto de la anchura de la rendija sobre los espectroscompuestos por picos estrechosSe utiliza el espectro de una disolución de cloruro de praseodimio conrendijas ajustables a 1,0; 0,5 y 0,1 mmLos valores de absorbancia aumentan significativamente (hasta un 70 por100 en uno de los casos) cuando la anchura de la rendija disminuyePara ajustes de la rendija menores de aproximadamente 0,14 mm, lasabsorbancias eran independientes de la anchura de la rendijaLas áreas bajo los picos individuales son las mismas, pero anchuras derendija elevadas dan lugar a picos mas anchos y mas bajos47
La medida cuantitativa de las bandas de absorción estrechas requierenel uso de anchuras de rendija estrechas o, alternativamente, ajustes deanchura de rendija muy reproduciblesUna disminución en la anchura de rendija va acompañada por unareducción exponencial de segundo orden en la energía radiante; cuandose usan ajustes muy estrechos pueden perderse detalles espectralescomo consecuencia de un aumento en la relación señal/ruidoEsta situación se hace particularmente importante en las regionesespectrales en las cuales la señal de salida de la fuente o la sensibilidaddel detector son bajas El ruido, puede originar una pérdida parcial o total de la estructura fina delespectroEn general, desde el punto de vista práctico, es aconsejable no estrecharla rendija más de lo necesarioGeneralmente, se observan alturas de pico constantes cuando la anchurade banda efectiva del instrumento es 0,1 mm ó inferior a la anchura debanda efectiva del pico de absorción48
Efecto de la radiación dispersada.Longitudes de onda extremas de uninstrumento La radiación dispersa puede causar desviaciones instrumentales de la leyde BeerCuando las medidas se realizan a las λ extremas de un instrumento, losefectos de la radiación parasita pueden ser más importantesEn ocasiones pueden llevar a la aparición de falsos picos de absorciónEjemplo:Consideremos un espectrofotometro que trabaja en la región visibleequipado con óptica de vidrio, fuente de wolframio y célula fotovoltaicacomo detectorA longitudes de onda inferiores a 380 nm, las ventanas, cubetas y prismacomienzan a absorber radiación, reduciendo así la energía que llega aldetectorLa señal de salida de la fuente también desciende rápidamente en estaregión; la sensibilidad del dispositivo fotoeléctrico también disminuyeComo consecuencia de ello la señal total para el ajuste del 100 % de Tpuede ser tan baja como el 1 ó 2 % de la señal correspondiente a laregión comprendida entre 500 y 650 nm49
Intensidad de la radiación emitida por lasfuentes típicas en la zona UV-visible50
Efecto de la radiación dispersada.Longitudes de onda de mayor sensibilidadde un instrumento Cuando la radiación dispersa está constituida por λ a lascuales el instrumento es muy sensible, el efecto de laradiación dispersa puede ser muy importante En algunos casos, la señal de salida producida por laradiación parasita puede exceder a la del haz queprocede del monocromador En estos casos la absorbancia medida procede tanto dela radiación parasita como de la radiación que se haseleccionado en el instrumento Ejemplo de la aparición de un falso pico a laslongitudes extremas de un espectrofotómetro de laregión visible Elespectro B corresponde a un dispositivo con ópticade cuarzo Elespectro A (correspondiente a un espectrofotómetrosencillo) muestra un falso pico por el efecto de laradiación dispersa correspondiente a λ 400 nm, que noson absorbidas por el cromóforo (cerio (IV))51
Cómo se aplica y se utiliza la espectroscopía UV-visibleLA MAGNITUD DE LAS ABSORTIVIDADES MOLARES Empíricamente,en espectrometría de absorción molecularultravioleta y visible se observan ε desde cero hasta 105 Paraun pico particular, la magnitud de ε depende de la seccióntransversal de captura de las especies y de la probabilidad deque tenga lugar una transición al absorber energía. Se hademostrado que la relación entre ε y estas variables esε 8,7 x 10-19 P A SiendoP la probabilidad de que se produzca la transición y A elárea de la sección transversal de la molécula en centímetroscuadrados.52
Cómo se aplica y se utiliza la espectroscopía UVvisible Para las transiciones permitidas según lamecánica cuántica que dan lugar a bandas deabsorción intensas (ε 104 a 105 ), los valoresde P están comprendidos entre 0,1 y 1 Los picos que tienen ε 103 se clasifican comode baja intensidad Son el resultado de las llamadas transicionesprohibidas, que tienen una probabilidad de inferiora 0,0153
Especies absorbentes. Cromóforos La absorción de radiación UV-vis por una especieatómica o molecular M se puede considerar como unproceso en dos etapas: 1) Excitación electrónica como se muestra en la ecuaciónM hv M* El producto de la reacción entre M y el fotón hv es unaespecie excitada electrónicamente simbolizada por M*.El tiempo de vida de la especie excitada es breve (10-8 a10-9 s), produciéndose distintos proceso de relajación.2) Relajación en especial la conversión de esa energía deexcitación en calorM * Æ M calor54
Otras formas de relajación molecular La relajación puede producirse también por la descomposicion de M*para dar lugar a nuevas especies; dicho proceso se denominareacción fotoquímica. Otros casos la relajación puede suponer la reemisión defluorescencia o fosforescencia. Es importante destacar que el tiempo de vida de M* esgeneralmente, muy pequeño y su concentración en cualquiermomento es despreciable. Además, la cantidad de energía térmica desarrollada en la relajaciónno es, habitualmente, detectable. Por ello, en las medidas deabsorción crean una mínima perturbación del sistema en estudioexcepto cuando tiene lugar la descomposición fotoquímica.55
Otras formas de relajación molecular La absorción de radiación ultravioleta o visible resulta, generalmente, de laexcitación de los electrones de enlace; como consecuencia, los picos deabsorción pueden correlacionarse con los tipos de enlaces de las especiesobjeto de estudio.La espectroscopia de absorción molecular es, por tanto, válida paraidentificar grupos funcionales en una molécula.Son importantes las aplicaciones de la espectroscopia de absorciónultravioleta y visible en la determinación cuantitativa de compuestos quecontienen determinados grupos absorbentes.Podemos citar tres tipos de transiciones electrónicas de interés en UVvisible: (1) electrones σ, π y n(2) eleclrones d y f(3) electrones de transferencia de carga56
Especies absorbentes que contienenelectrones σ, π y n Las especies absorbentes que contienen electrones σ, π y n sonfundamentalmente iones y moléculas orgánicas, así como algunosaniones inorgánicos. Consideraremos especialmente las primeras. Todos los compuestos orgánicos son capaces de absorberradiación electromagnética por sus enlaces de tipo σ. La energía de excitación asociada a los electrones que constituyenla mayoría de los enlaces sencillos es lo suficientemente alta paraque su absorción quede restringida a la región ultravioleta de vació(λ 185 nm), donde también absorben los componentes de laatmósfera.57
Especies absorbentes que contienenelectrones σ, π y n Las dificultades experimentales asociadas con elultravioleta de vacío son muy importantes, por ello, lamayoría de los estudios de compuestos orgánicos sellevan a cabo a longitudes de onda superiores a 185nm. La absorción de radiación visible y ultravioleta delongitud de onda más larga están no obstanterestringida a un numero limitado de gruposfuncionales (cromóforos) que contienen electrones devalencia con energías de excitación relativamentebajas.58
Tipos de electrones absorbentes Los electrones que contribuyen a la absorción en unamolécula orgánica son: (1) enlazantes, que participan directamente en la formación deenlaces entre átomos, asociándose con más de uno de ellos(2) no enlazantes o electrones que no participan en ningúnenlace que están en gran parte localizados alrededor de átomoscomo oxigeno, halógenos, azufre y nitrógenoLos O.M. son el resultado del solapamiento de O.A. Cuandose combinan 2 O.A se origina 1 O.M. enlazante (baja energía)y otro antienlazante (alta energía)Los orbitales moleculares asociados con los enlaces sencillos,en las moléculas orgánicas, se denominan orbitales sigma(σ), y los electrones correspondientes son electrones σ.59
Tipos de electrones absorbentes La distribución de la densidad de carga de un orbital sigma esrotacionalmente simétrica alrededor del eje del enlace. El doble enlace en una molécula orgánica contiene dos tipos deorbitales moleculares: un orbital sigma (σ) correspondiente a un parde electrones enlazantes y un orbital molecular pi (π) asociado conel otro par. Los orbitales π se forman por el solapamiento paralelo de orbitalesatómicos p. Su distribution de carga se caracteriza por un planonodal a lo largo del eje del enlace y una densidad máxima en lasregiones superior e inferior al plano(c) orbital π(d) orbital π*60
Muchas moléculas orgánicas contienen electrones noenlazantes. Estos electrones, se designan con el símbolo n.La energía para los distintos tipos de orbitales molecularesdifiere significativamente.El nivel de energía de un electrón no enlazante se encuentraentre niveles de energía de los orbitales π y σ enlazantes yantienlazantes.Las transiciones electrónicas entre los distintos niveles deenergía, son posible cuatro tipos de transiciones σ σ*n σ *n π*π π*61
Transiciones σ σ*. Poseen una energía asociada muy elevada, y origina bandas deabsorción en el UV de vacío. Por ellos no tienen interés práctico y no se le dedica atenciónen análisis Transiciones n σ * . Los compuestos saturados que contienen pares de electrones nocompartidos (electrones no enlazantes). En general, estas transiciones requieren menosenergía que las del tipo σ σ* y originan absorciones en la región comprendida entre 150 y250 nm, apareciendo, la mayoría de los picos de absorción, por debajo de 200 nm. La Tabla 14-1 muestra los datos de absorción de algunas transiciones n σ *características. Los requerimientos energéticos para dichas transiciones dependen fundamentalmente deltipo de enlace y en menor medida de la estructura de la molécula. Las absortividades molares se encuentran entre 100 y 3000 l mol-1 cm-1Los máximos de absorción tienden a desplazarse a longitudes de onda más cortas enpresencia de disolvente polares como agua o etanol62
Transiciones nÆπ* y π Æπ* Las transiciones al estado n,π* son generalmente bajas ynormalmente las ε se encuentran entre 10 y 100 l mol-1 cm-1las transiciones π,π* poseen valores ente 1000 y 10000 l mol-1 cm1.Otra diferencia característica entre los dos tipos de transicioneses: Los picos asociados a transiciones n,π* se desplazan a longitudesde onda más cortas (desplazamiento hipsocrómico o hacia elazul), cuando aumenta la polaridad del disolvente Los picos asociados a transiciones π,π* se desplazan a longitudesde ondas más largas (desplazamiento batocrómico, hacia el rojo)63
Transiciones nÆπ* y π Æπ* El efecto hipsocromico surge de una mayor solvatación delpar de electrones no enlazantes que disminuye la energía delorbital n Æ salto mayor Æ mayor ε Æ λ corta Los efectos de este tipo más intenso (desplazamiento haciael azul de 30 nm o más) se observan con disolventes polarespróticos, como agua o alcohol, en los cuales es frecuente laformación de enlaces de hidrógeno entre los protones deldisolvente y el par de electrones no enlazantes64
Cromóforos orgánicos Los máximos permiten la identificación de gruposfuncionales, pero esta identificación es difícil (efecto deldisolvente, etc) Efecto de la conjugación de los cromóforos En la teoría de los orbitales moleculares, se consideraque los electrones π están deslocalizados porconjugación El efecto de esta deslocalización es el descenso del nivelde energía del orbital π*, dotándole de menos carácterantienlazante. Como consecuencia, los máximos de absorción sedesplazan hacia longitudes de onda mas largas (menorenergía y mayor λ).65
Cromóforos orgánicos Como se ve en la Tabla la absorción de los multicromóforos en unamolécula orgánica sencilla, es aproximadamente aditiva. O
Espectrofotometría UV-visible El instrumento tipo: parámetros de interés y calibración.-Descripción de aplicaciones frecuentes.- Selección de procedimientos adecuados para problemas concretos.- Uso de la espectrofotometría UV-visible como sistema de detección en otras técnicas instrumentales










